目前,随着疫情防控措施逐步優化,大多(duō)數人都經曆了“陽過”,切身感受到了體(tǐ)内免疫細胞與新(xīn)冠病毒撕殺的痛苦,免疫力強的年輕人抗過一周後就成功康複,但不少人好轉後依然沒有(yǒu)味覺和嗅覺,感到呼吸困難、過敏、認知障礙、乏力、胸悶等後遺症,後疫情時代新(xīn)冠後遺症的康複受到了廣泛關注。

新(xīn)冠後遺症成了全球公(gōng)共衛生問題
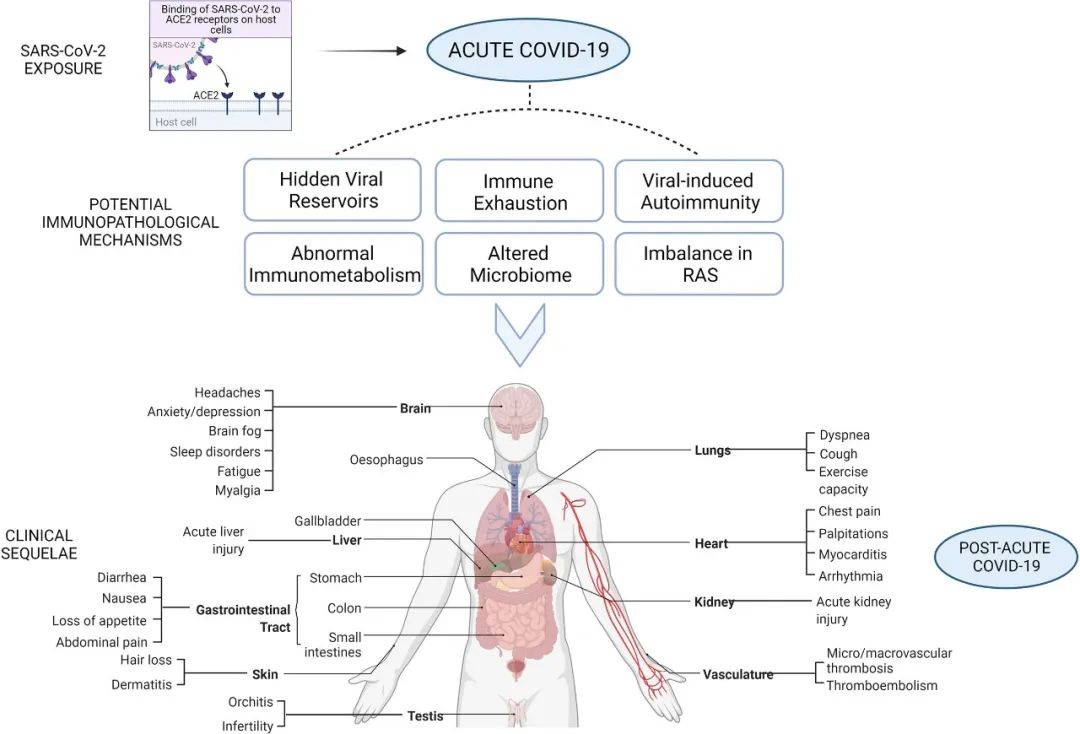
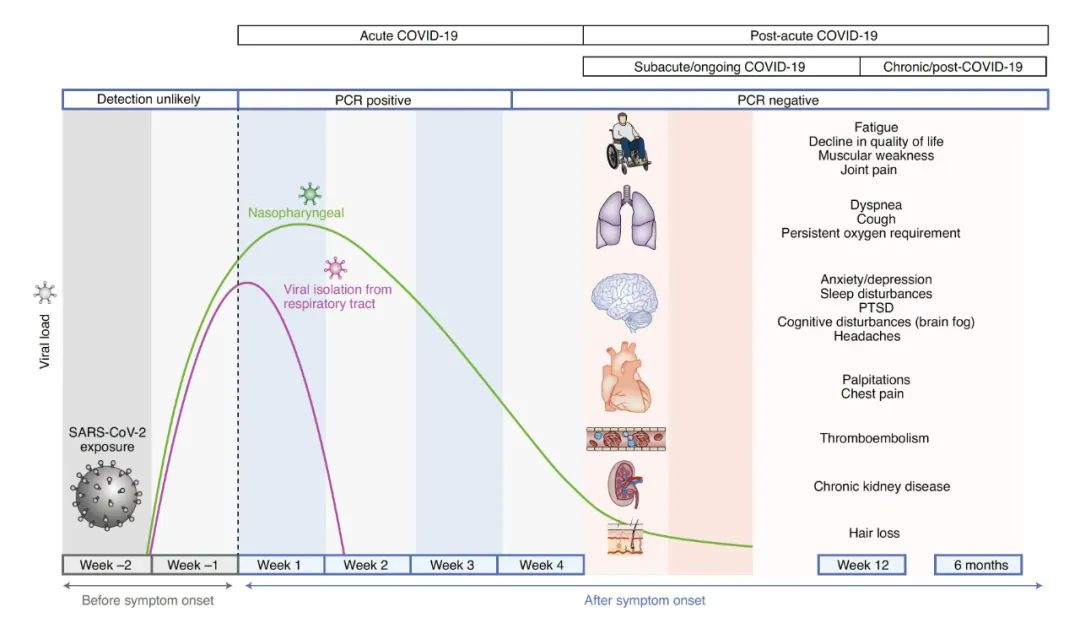
世衛組織2021年10月公(gōng)布的官方定義中(zhōng):新(xīn)冠長(cháng)期症狀,即常說的新(xīn)冠後遺症,通常在感染新(xīn)冠3個月後出現,它不會因為(wèi)轉陰而消失,症狀至少要持續2個月以上。2022年8月6日,荷蘭格羅甯根大學(xué)的 Judith G M Rosmalen 教授在國(guó)際頂尖醫(yī)學(xué)期刊《柳葉刀(dāo)》上發表了題為(wèi):Persistence of somatic symptoms after COVID-19 in the Netherlands: an observational cohort study 的研究論文(wén),研究發現,每8名(míng)新(xīn)冠肺炎幸存者中(zhōng)就會有(yǒu)1人出現“長(cháng)期新(xīn)冠”症狀。《自然》2021年發表了:More than 50 long-term effects of COVID-19: a systematic review and meta-analysis,文(wén)章指出有(yǒu)高達兩百餘種複雜症狀在新(xīn)冠治愈後仍困擾患者。根據哈佛公(gōng)共衛生學(xué)院的一項研究,4萬多(duō)名(míng)納入研究的患者涉及極度疲憊(58%)、頭痛(44%)、注意力障礙(27%)、脫發(25%)、呼吸障礙(24%)等50餘種主要症狀。
《EClinicalMedicine》上一篇“Characterizing long COVID in an international cohort: 7 months of symptoms and their impact”文(wén)章,“針對3762名(míng)長(cháng)期新(xīn)冠患者”的研究就提到:綜合先前的研究、病例等各方數據,新(xīn)冠後遺症可(kě)能(néng)會涉及疲勞、腦霧、記憶力減退、關節疼痛、眩暈等203種症狀,累及全身10個器官系統。
新(xīn)冠病毒感染導緻肺纖維化高發
肺部作(zuò)為(wèi)新(xīn)冠病毒主要攻擊的器官之一,往往是後遺症的“重災區(qū)”, 嚴重炎症風景導緻肺部出現炎性組織損傷,會出現結構破壞,“瘢痕組織”生長(cháng),導緻肺組織變硬,彈性差、氣體(tǐ)通過困難包,導緻了患者長(cháng)期的呼吸困難。
《Nature Medicine 》2021年發表了:Post-acute COVID-19 syndrome,研究指出呼吸困難在 60~100 天的随訪期内的發生率為(wèi) 42%~66%,有(yǒu) 6.6% 的患者因持續低氧血症需要補充氧氣。患者出院後 3 個月評估發現約 25% 的輕度至中(zhōng)度病例存在纖維化,在重症病例居多(duō)的隊列中(zhōng),約 65% 的康複者存在肺纖維化。
2021年8月28日,國(guó)際頂尖醫(yī)學(xué)期刊《柳葉刀(dāo)》刊發中(zhōng)日友好醫(yī)院曹彬教授的研究論文(wén):1-year outcomes in hospital survivors with COVID-19: a longitudinal cohort study,顯示住院患者出院 1 年之後呼吸困難發生率仍高達 30%,55.1% 的患者存在至少一個異常 CT 表型。
根據2022年3月發表在《柳葉刀(dāo)》上的論文(wén),美國(guó)研究人員使用(yòng)美國(guó)退伍軍人事務(wù)部的國(guó)家數據庫建立了一個由 181280 名(míng)參與者組成的隊列,這些參與的退伍軍人均沒有(yǒu)糖尿病史,在 2020 年 3 月 1 日至 2021 年 9 月 30 日期間的 COVID-19 檢測呈陽性,并在COVID-19感染後的30 天幸存下來。
經過352天的随訪發現,在COVID-19疾病的後期,COVID-19與糖尿病發病風險增加顯著相關。非住院新(xīn)冠患者在感染後12個月時,每1000個人中(zhōng)就有(yǒu)8.28例糖尿病,即使是在接觸COVID-19之前糖尿病風險較低的人也表現出更高的風險。
● 新(xīn)冠病毒感染直接導緻的組織細胞損傷
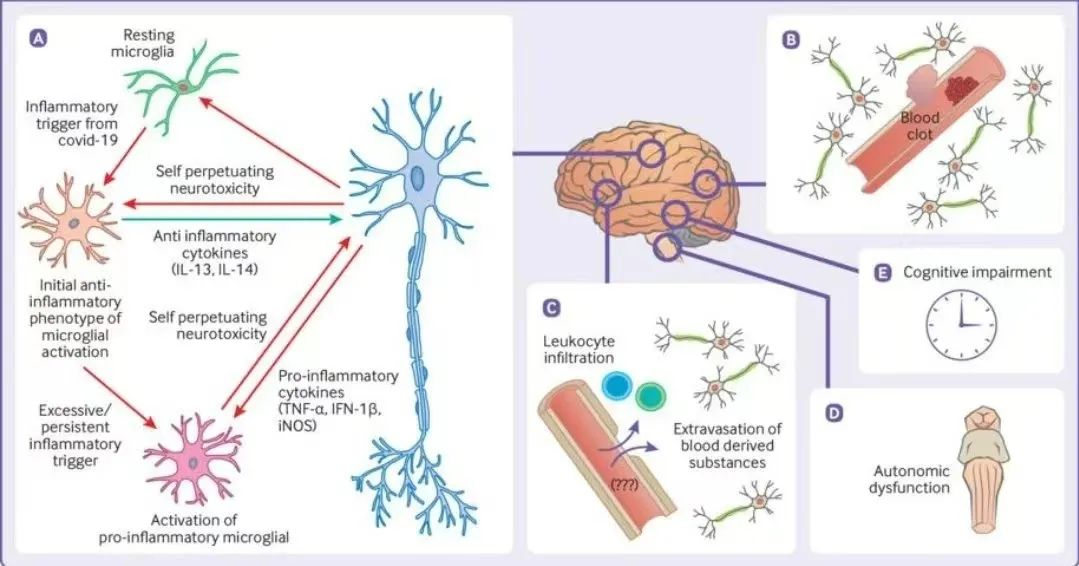
研究發現,新(xīn)冠病毒在肺部内皮細胞内的複制,會對肺和呼吸道造成嚴重損害;在心血管系統内,新(xīn)冠病毒直接感染心肌細胞和内皮細胞,導緻心肌細胞的凋亡和内皮細胞損傷;在其他(tā)的組織和器官中(zhōng),新(xīn)冠病毒的感染,也會導緻相關細胞的死亡,進而影響器官的功能(néng),誘發新(xīn)冠後遺症。
● 潛在的病毒庫或非傳染性新(xīn)冠病毒片段引發慢性炎症
很(hěn)多(duō)研究在感染者的多(duō)種器官中(zhōng)檢測到了新(xīn)冠病毒的存在,因此這些器官有(yǒu)可(kě)能(néng)成為(wèi)新(xīn)冠病毒的潛在「病毒庫」,新(xīn)冠病毒部分(fēn)核酸序列可(kě)以整合到人的基因組中(zhōng),而且整合到人體(tǐ)基因組中(zhōng)的新(xīn)冠病毒片段能(néng)夠正常轉錄,由于病毒庫或病毒片段的持續存在,引發的慢性炎症造成了新(xīn)冠後遺症的發生。
● 新(xīn)冠病毒導緻免疫系統耗竭
當免疫細胞被病毒抗原持續長(cháng)時間刺激,就會出現功能(néng)障礙甚至耗竭。有(yǒu)研究發現,在重症新(xīn)冠患者體(tǐ)内,細胞毒性 T 淋巴細胞(CTL)和自然殺傷細胞(NK)等抗病毒淋巴細胞的絕對數量明顯減少,功能(néng)耗竭。還有(yǒu)研究發現,在新(xīn)冠感染期間,淋巴和骨髓細胞上很(hěn)多(duō)免疫抑制受體(tǐ)表達水平上調。這種免疫抑制和免疫細胞的耗竭,可(kě)能(néng)會促進新(xīn)冠感染,進而導緻新(xīn)冠後遺症。
● 新(xīn)冠病毒誘導的自身免疫反應
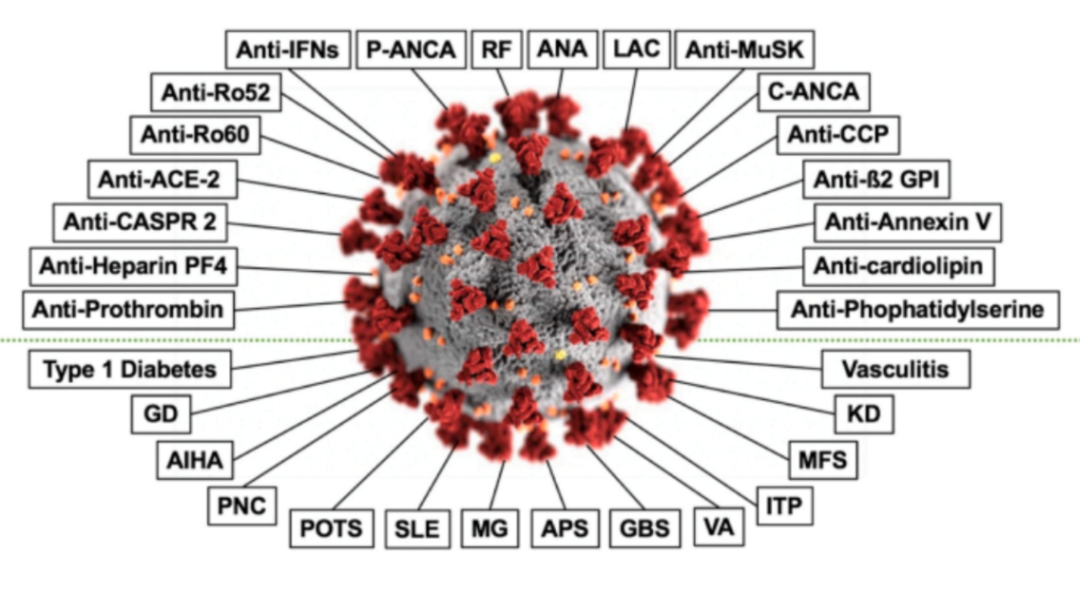
新(xīn)冠病毒感染後免疫細胞都“殺瘋了”---導緻細胞因子的過度産(chǎn)生和免疫細胞的過度激活,免疫耐受的打破導緻自身抗體(tǐ)的産(chǎn)生,在新(xīn)冠病毒感染者中(zhōng)發現了多(duō)種自身免疫性疾病中(zhōng)的自身抗體(tǐ),這些自身抗體(tǐ)對患者的病情有(yǒu)不同程度的影響。Pascolini等人檢測了33例新(xīn)冠肺炎患者中(zhōng)抗核抗體(tǐ)(ANA)、抗胞漿中(zhōng)性粒細胞抗體(tǐ)(ANCA)和抗抗磷脂抗體(tǐ)(APL)。結果顯示,45%的患者至少一種自身抗體(tǐ)陽性,自身抗體(tǐ)陽性的患者往往預後較差,入院時呼吸頻率明顯較高。
新(xīn)冠病毒感染還可(kě)通過分(fēn)子模拟引發交叉反應,導緻患者産(chǎn)生自身免疫反應。有(yǒu)文(wén)獻報道SARS-CoV-2 S蛋白(spike glycoprotein)與人類至少26種以上蛋白質(zhì)存在多(duō)肽同源性,新(xīn)冠病毒感染後,人體(tǐ)針對新(xīn)冠病毒的免疫反應可(kě)能(néng)會和自身蛋白質(zhì)(與病毒共享肽序列)發生交叉反應,從而導緻自身免疫性病理(lǐ)損傷發生。
幹細胞技(jì )術助力新(xīn)冠後遺症的康複
新(xīn)冠後遺症形式多(duō)樣、機制複雜、作(zuò)用(yòng)廣泛、影響深遠(yuǎn)、發生率高,新(xīn)冠後遺症已然成為(wèi)全球的公(gōng)共衛生隐患,如何預防與治療已經成了當前的焦點。
目前,接種疫苗是預防新(xīn)冠後遺症的重要策略,抗病毒治療降低進展到重症的風險有(yǒu)利于預防新(xīn)冠後遺症,間充質(zhì)幹細胞前期已用(yòng)于新(xīn)冠重症患者的治療,有(yǒu)效降低重症患者的死亡率和後遺症,幹細胞是新(xīn)冠後遺症康複療法的一個重要探索方向。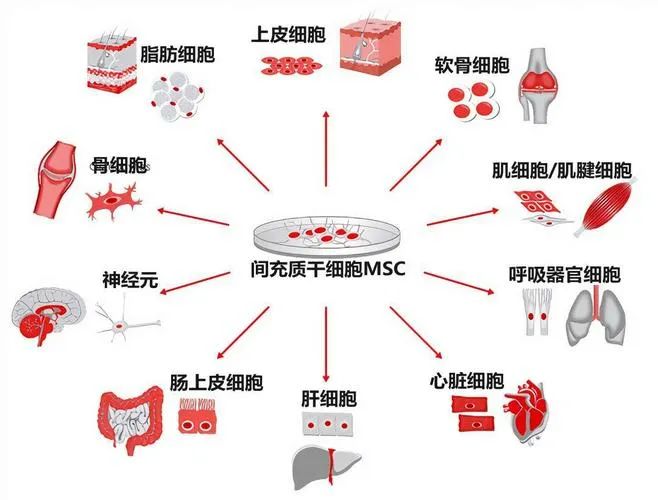
間充質(zhì)幹細胞(MSC)是一類具(jù)有(yǒu)自我更新(xīn)及多(duō)向分(fēn)化能(néng)力的原始細胞,在特定條件下,它能(néng)夠在體(tǐ)外分(fēn)化成人體(tǐ)多(duō)種細胞,包括成骨細胞、脂肪細胞、軟骨細胞等,能(néng)夠很(hěn)好的補充機體(tǐ)損傷的細胞,替代衰老及死亡的細胞。間充質(zhì)幹細胞具(jù)有(yǒu)免疫調節作(zuò)用(yòng),是“炎症終結者”,能(néng)通過旁分(fēn)泌功能(néng),和與免疫細胞相互作(zuò)用(yòng)的免疫效應,調節免疫反應,最終促使炎症反應下調,減輕過激的免疫反應。
針對新(xīn)冠肺炎後遺症,幹細胞主要有(yǒu)兩大方面作(zuò)用(yòng):
一是針對免疫過度激活,幹細胞可(kě)以增強機體(tǐ)免疫調節功能(néng),抑制免疫系統過度激活,抑制炎症反應,與此同時還可(kě)以提高抗病毒能(néng)力;二是幹細胞可(kě)以分(fēn)化為(wèi)多(duō)種細胞來替換死亡、沒有(yǒu)功能(néng)的細胞,改善微環境,促進内源性修複,修複肺部、心髒和神經系統等損傷。
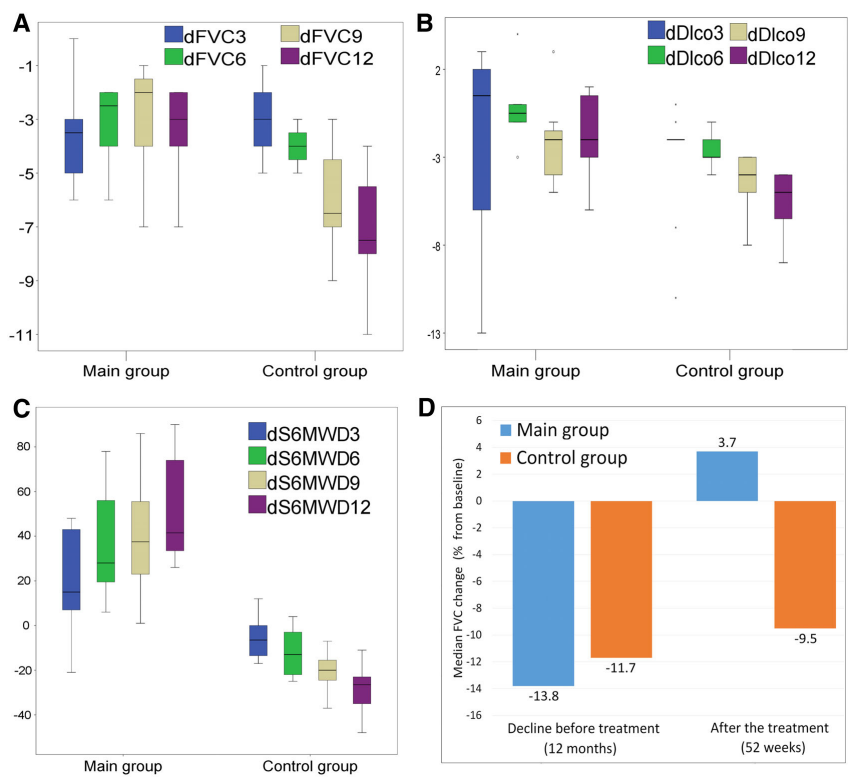
2020年1月15日《Stem cells translational medicine》雜志(zhì)上發表了一篇題名(míng)為(wèi)《First-in-human high-cumulative dose stem cell therapy in idiopathic pulmonary fibrosis with rapid lung function decline》,文(wén)章公(gōng)布了幹細胞治療特發性肺纖維化伴肺功能(néng)快速下降的臨床研究結果,同安(ān)慰劑組相比,MSC治療組的FVC(用(yòng)力肺活量)、DLCO(一氧化碳彌散量)、6MWTD(6分(fēn)鍾步行距離測試距離)各項指标相對于都有(yǒu)所提升。
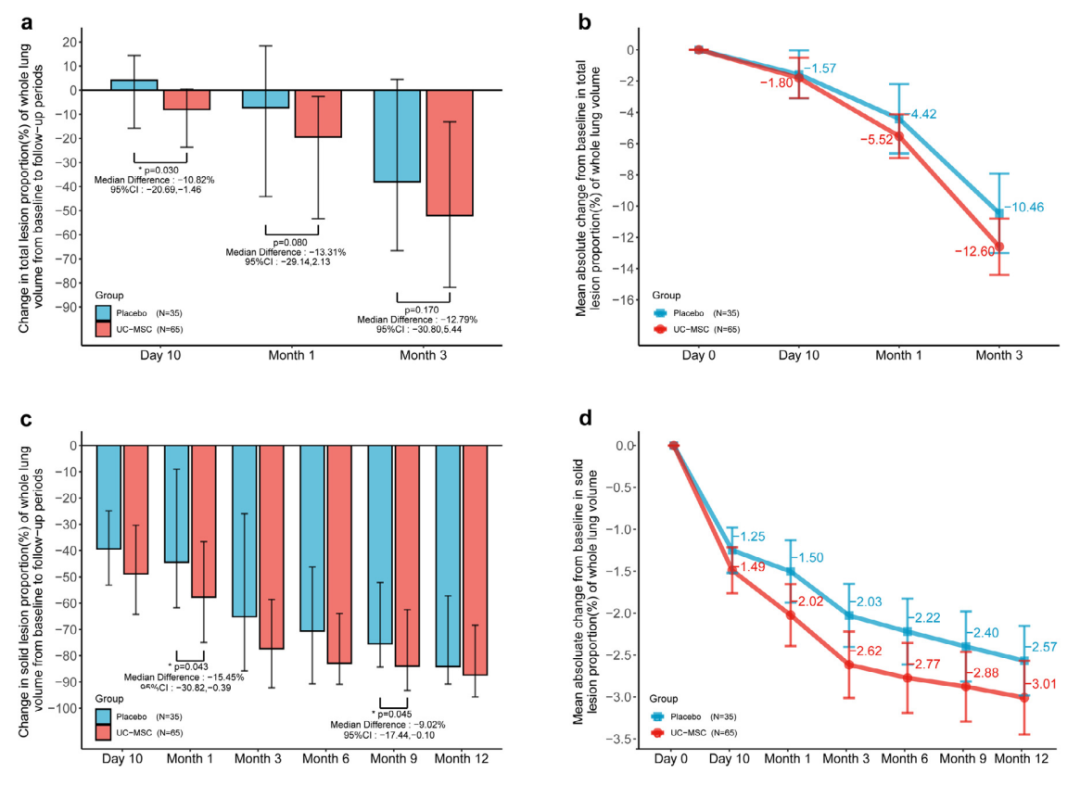
2022年2月,中(zhōng)國(guó)科(kē)學(xué)院院士、解放軍總醫(yī)院第五醫(yī)學(xué)中(zhōng)心感染病診療與研究中(zhōng)心主任、感染病醫(yī)學(xué)部主任王福生及其團隊在《EBioMedicine》發表了:Human mesenchymal stem cells treatment for severe COVID-19: 1-year follow-up results of a randomized, double-blind, placebo-controlled trial,公(gōng)布了使用(yòng)臍帶間充質(zhì)幹細胞(UC-MSCs)回輸治療COVID-19重症患者随訪1年的結果:臍帶間充質(zhì)幹細胞給藥對新(xīn)冠肺炎患者肺部病變和症狀的恢複具(jù)有(yǒu)長(cháng)期益處,且患者症狀更輕和生活質(zhì)量更好,睡眠困難、日常活動和數字評定量表評分(fēn)均得到顯著改善。
2022年多(duō)國(guó)學(xué)者聯合在《Stem Cell Research & Therapy》上發表綜述:Shining the light on clinical application of mesenchymal stem cell therapy in autoimmune diseases ,探讨了間充質(zhì)幹細胞治療自身免疫性疾病的潛在機制,以及介紹了間充質(zhì)幹細胞在多(duō)種免疫性疾病中(zhōng)的有(yǒu)效性和可(kě)行性,這些疾病包括類風濕性關節炎、I型糖尿病、多(duō)發性硬化症、系統性紅斑狼瘡、炎症性腸病、自身免疫性肝病以及幹燥綜合症等。目前國(guó)内外多(duō)個治療GVHD、SLE、類風濕性關節炎的間充質(zhì)幹細胞進入了臨床應用(yòng)和研究。
2022年5月3日,由解放軍總醫(yī)院内分(fēn)泌科(kē)母義明教授和生物(wù)治療中(zhōng)心韓衛東教授在《Stem Cells Research&Therapy》雜志(zhì)上Efficacy and safety of umbilical cord-derived mesenchymal stem cells in Chinese adults with type 2 diabetes:a single-center, double-blinded, randomized, placebo-controlled phase II trial,公(gōng)布了一項單中(zhōng)心、随機、雙盲對照間充質(zhì)幹細胞治療2型糖尿病II期臨床研究結果。
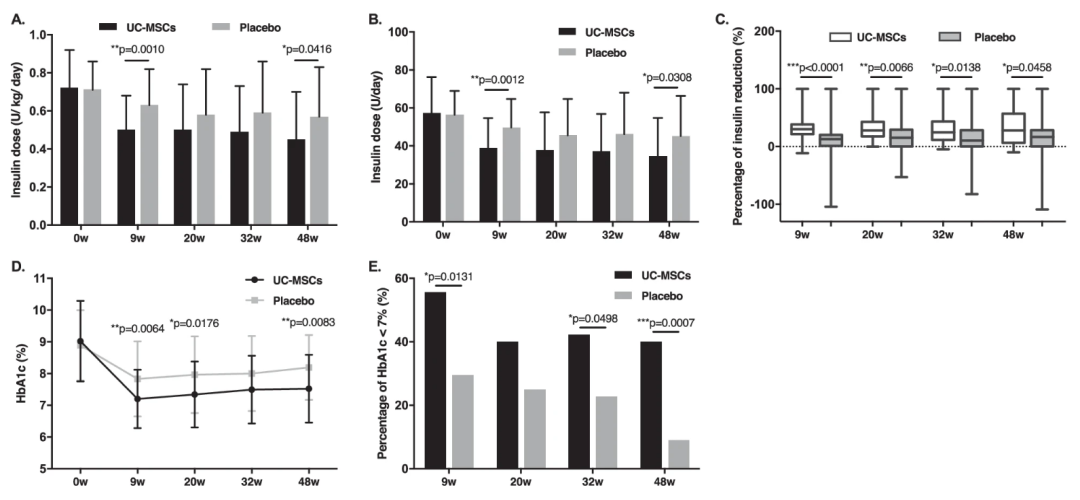
治療所用(yòng)的細胞是來自臍帶中(zhōng)提取的臍帶間充質(zhì)幹細胞(UC-MSCs),傳代四次,符合資格标準的患者随機分(fēn)配接受三次靜脈輸注臍帶間充質(zhì)幹細胞(100mL)或相同體(tǐ)積外觀的安(ān)慰劑,回輸細胞臍帶間充質(zhì)幹細胞數為(wèi)1×10^6/kg,每次間隔4周。
結果顯示,通過靜脈輸注給予臍帶間充質(zhì)幹細胞是一種安(ān)全有(yǒu)效的方法,可(kě)以減少外源性胰島素需求,緩解II型糖尿病患者的胰島素抵抗。臍帶間充質(zhì)幹細胞移植是II型糖尿病的潛在治療選擇。
目前,臨床上在繼續探索新(xīn)冠後遺症的機制,深入了解新(xīn)冠後遺症的成因,開展多(duō)種治療新(xīn)冠後遺症的療法探索,幹細胞療法從治療新(xīn)冠轉向幹預長(cháng)期新(xīn)冠症狀的研究,在全球科(kē)學(xué)家的共同努力下,相信幹細胞療法将為(wèi)飽受新(xīn)冠後遺症折磨的患者帶來康複的希望。[1]. Liu YH, Chen Y, Wang QH, et al. One-Year Trajectory of Cognitive Changes in Older Survivors of COVID-19 in Wuhan, China: A Longitudinal Cohort Study. JAMA Neurol. 2022;
[2]. Lopez-Leon S, Wegman-Ostrosky T, Perelman C, et al. More than 50 Long-term effects of COVID-19: a systematic review and meta-analysis. Preprint. medRxiv. 2021;2021.01.27.21250617.[3]. Al-Aly Z, Bowe B, Xie Y. Long Covid after Breakthrough COVID-19: the post-acute sequelae of breakthrough COVID-19[J]. 2021.[4]. Mehandru S, Merad M. Pathological sequelae of long-haul COVID. Nat Immunol. 2022;23(2):194-202.[5]. Cohen K, Ren S, Heath K, et al. Risk of persistent and new clinical sequelae among adults aged 65 years and older during the post-acute phase of SARS-CoV-2 infection: retrospective cohort study. BMJ. 2022;376:e068414.[6]. Deuel J W, Lauria E, Lovey T, et al. Persistence, prevalence, and polymorphism of sequelae after COVID-19 in young adults[J]. medRxiv, 2022.[7]. Nalbandian A, Sehgal K, Gupta A, et al. Post-acute COVID-19 syndrome. Nat Med. 2021;27(4):601-615.[8]. Huang L, Yao Q, Gu X, et al. 1-year outcomes in hospital survivors with COVID-19: a longitudinal cohort study. Lancet. 2021;398(10302):747-758.[9]. Ramakrishnan RK, Kashour T, Hamid Q, et al. Unraveling the Mystery Surrounding Post-Acute Sequelae of COVID-19. Front Immunol. 2021;12:686029.[10]. Crook H, Raza S, Nowell J, Young M, Edison P. Long covid-mechanisms, risk factors, and management. BMJ. 2021;374:n1648. Published 2021 Jul 26.[11]. Siripanthong B, Asatryan B, Hanff TC, et al. The Pathogenesis and Long-Term Consequences of COVID-19 Cardiac Injury: State-of-the-Art Review. JACC Basic Transl Sci.[12] Human mesenchymal stem cells treatment for severe COVID-19: 1-year follow-up results of a randomized, double-blind, placebo-controlled trial. https://doi.org/10.1016/j.ebiom .2021.103789[13] Zang, L., Li, Y., Hao, H. et al. Efficacy and safety of umbilical cord-derived mesenchymal stem cells in Chinese adults with type 2 diabetes: a single-center, double-blinded, randomized, placebo-controlled phase II trial. Stem Cell Res Ther 13, 180 (2022). https://doi.org/10.1186/s13287-022-02848-6[14]Jasim, S.A., Yumashev, A.V., Abdelbasset, W.K. et al. Shining the light on clinical application of mesenchymal stem cell therapy in autoimmune diseases. Stem Cell Res Ther 13, 101 (2022). https://doi.org/10.1186/s13287-022-02782-7.